تسریع کشف و توسعه سلول درمانی با مهندسی ژن غیر ویروسی
مهندسی ژنتیک سلول های ایمنی ابزاری قدرتمند برای ایجاد درمان های سلولی پیشرفته و جدید است. در حال حاضر، مرحله حیاتی ویرایش ژن سلولی عمدتاً با استفاده از سیستم های انتقال ژن مبتنی بر ویروس انجام می شود.
مهندسی ژنتیک سلول های ایمنی ابزاری قدرتمند برای ایجاد درمان های سلولی پیشرفته و جدید است. در حال حاضر، مرحله حیاتی ویرایش ژن سلولی عمدتاً با استفاده از سیستم های انتقال ژن مبتنی بر ویروس انجام می شود. روشهای مهندسی مبتنی بر ویروس معمولاً با زمان طولانی، عدم تکرارپذیری، ظرفیت حمل کم و هزینههای بالا مواجه هستند. اخیراً، پیشرفتها در مهندسی ژن مبتنی بر ترانسپوزون غیر ویروسی، یک روش مهندسی ژن جایگزین را در اختیار توسعهدهندگان قرار داده است که محدودیتهای پلتفرم مبتنی بر ویروس را برطرف میکند. با استفاده از روش «برش و چسباندن» تحویل ژن، سیستمهای مبتنی بر ترانسپوزون قادر به ادغام ژنومی پایدار هستند.
سیستم ترانسپوزون TcBuster برای کاربردهای سلول درمانی شامل مهندسی ژن و همچنین بیان، تأیید و اعتبارسنجی هدف می باشد. TcBuster یک پلتفرم ویرایش ژن غیر ویروسی است که برای ادغام پایدار یک ژن هدف (GOI) در ژنوم تراز شده است.
TcBuster بخشی از خانواده hAT، یکی از بزرگترین خانواده های ترانسپوزازهای موجود در طبیعت است. عناصر ترانسپوزون موفق با تکثیر عمودی در دودمان تک گونه میزبان و با انتقال افقی بین گونه ها تکثیر شده و تنوع می یابند. ترانسپوزازها با فعالیت و مکانیسم های محدودی برای تنظیم تکامل یافته اند تا از بی ثباتی ژنومی و سمیت بیش از حد برای میزبان خود جلوگیری کنند.
دلیل رانش ژنتیکی و سازگاری با گونه میزبان تمایل به تنوع دارند. بنابراین، ما یک TcBuster بسیار فعال با ترکیب اسیدهای آمینه حفظ شده فیلوژنتیکی از اعضای خانواده hAT مرتبط ساختهایم.
بیش از صد آمینو اسید اجماع شناسایی شده است، و یک کتابخانه ترکیبی تصادفی از این جهش ها تولید شد. جمعیت انبوه قبل از دسته بندی و توالی یابی سلول ها برای جهش با عملکرد بالا مورد آزمایش قرار گرفت. TcBuster transposase به صورت دستی ویرایش شد تا آمینو اسیدهای مرتبط با عملکرد بالا را برای ایجاد TcBuster VE7 را شامل شود.
برای افزایش بیشتر فعالیت TcBuster، یک روش کتابخانه ترکیبی با توان عملیاتی بالا برای غربالگری بیش فعالی استفاده شد. این جهش ها تحت تیمار DNAاز قرار گرفتند و به طور تصادفی مونتاژ شدند تا حاوی دو تا سه تغییر در هر آنزیم باشند. این کتابخانه از جهشهای TcBuster سپس به همراه سه ترانسپوزون جداگانه به سلولها معرفی شد که پروتئین فلورسنت سبز (GFP)، هیگرومایسین و mCherry را کد میکنند. فرض بر این بود که تنها یک TcBuster بسیار فعال می تواند سه ترانسپوزون جداگانه را به طور پایدار ادغام کند. پس از آن که سلول ها توسط هیگرومایسین غربال شدند، سلول ها بر اساس روشنایی برای GFP و mCherry مرتب گردیدند. سلولهای روشن جداسازی و توالییابی شدند تا جهشهای فعال TcBuster شناسایی شوند.
جهشهای امیدوارکننده TcBuster در سلولهای HeLa غربالگری شدند. اکثر جهش یافته ها عملکرد بهتری نسبت به TcBuster نوع وحشی داشتند. نشان داده شد که TcB-M فعال ترین جهش TcBuster است که در صفحه نمایش شناسایی شده است و کارایی انتقال را از 20٪ به بیش از 60٪ افزایش می دهد.
سختی غربالگری در سلول های T، با استفاده از آزمایش القا شده با ترانسپوزون تری سیسترونیک افزایش یافت. در ادامه این فرضیه مطرح شد که تنها یک TcBuster بسیار فعال می تواند محموله های بزرگ را به طور پایدار در سلول های T اولیه ادغام کند. جهش ها در سلول های T در مقایسه با VE7 مورد آزمایش قرار گرفتند. نتایج بیانگر این بود که بیشتر جهشیافتهها مشابه VE7 عمل میکنند، با این حال، TcB-M به وضوح از سایرین بهتر عمل میکند.
فعالیت TcB-M در سلول های T اولیه با استفاده از سه ناقل چند سیسترونیک جداگانه مورد تجزیه و تحلیل قرار گرفت. در هر مورد، بازده انتقال قابل توجهی بالاتر با TcB-M در مقایسه با VE7 مشاهده شد. این داده ها چندین بار در اهداکنندگان متعدد تکثیر شد و در نتیجه، TcB-M اکنون TcBuster پیشرو بیش فعال برای سلول و ژن درمانی است که در حال حاضر از طریق خدمات مهندسی ژن سفارشی استفاده می شود و انتظار می رود در آینده نزدیک وارد کاربرد بالینی شود.
سلولدرمانیهایی که به طور فزایندهای پیچیده میشوند، به ظرفیت حمل بیشتری نیاز دارند، که به خودی خود لنتیویروس را نامناسب میکند. بسیاری از مردم به دنبال سیستم های ترانسپوزون برای کمک به ادغام نسخه های بزرگتر هستند.
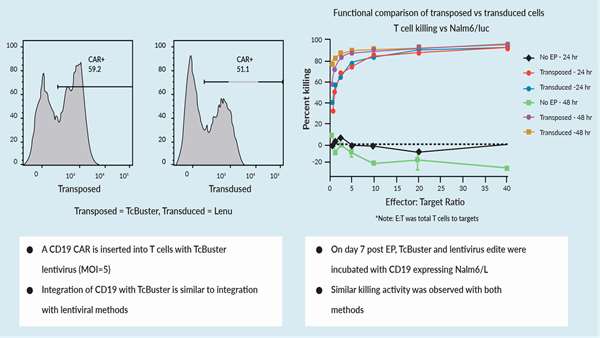
گردش کار ویرایش ژنتیکی برای سلولهای T و سلولهای کشنده طبیعی (NK) شامل فعالسازی، انتقال ژن و گسترش است. در مقایسه انتقال در مقابل انتقال با استفاده از لنتی ویروس در سلول های T، نشان داده شد که کارایی ویرایش TcBuster به اندازه لنتی ویروس است.
پلتفرم TcBuster را می توان برای پشتیبانی از مقیاس های مختلف تحقیقاتی و درمانی بهینه کرد. TcBuster را می توان در واکنش های مقیاس کوچک، متوسط و مقیاس بزرگ بدون افت از نظر بازده یا گسترش سلول استفاده کرد.
در جریان کار در مقیاس کوچک، 10 میلیون سلول الکتروپوره می شوند تا 250 تا 350 میلیون سلول در یک صفحه G-Rex™ 6M تولید شود. در مقیاس متوسط، 80 میلیون سلول الکتروپوره می شوند تا دو تا سه میلیارد سلول به عنوان خروجی تولید شود. الکتروپوراسیون در مقیاس بزرگ از 400 میلیون سلول کل، تقریباً 15 میلیارد سلول را به دست میدهد. برای هر یک از این مقیاس ها تقریباً نتیایج یکسانی حاصل می شود.
آزمایشها برای مقایسه قابلیتهای این سیستم برای بیان تراریخته استفاده شد. نکته اصلی این است که اطمینان حاصل شود که راندمان انتقال در مقیاس پایدار است. راندمان جابجایی برابر در همه مقیاسها یافت میشود، که نشان میدهد هر گونه تفاوت بین پروتئینها از نظر بیان احتمالاً به دلیل استفاده از معرفهای تشخیص مورد استفاده به جای مقیاس است.
یک آزمایش الکتروپوریشن منفرد برای انتقال و حذف انجام شد. ناک اوت بتا 2 میکروگلوبولین با انتقال گیرنده آنتی ژن کایمریک بی سیسترونیک CD19-GFP (CAR) با موفقیت کامل شد. با سیستم TcBuster، می توان از یک فرآیند یک مرحله ای برای انجام ناک اوت ها و تحویل ژن با واسطه TcBuster بدون به خطر انداختن کارایی رشد و ادغام استفاده کرد. این نتایج نشان میدهد که افزودن معرفهای تکرار
کوتاه پالیندرومیک (CRISPR)، RNA راهنما، ترانسپوزون و معرفهای TcBuster خوشهای، میتواند در یک الکتروپوریشن منفرد انجام شود که به طور موثر یک ناک اوت و یک ضربه را در یک عملیات واحد انجام میدهد.
انتقال CD19 CAR در سلولهای NK بر روی بسیاری از اهداکنندگان انجام شده است و نتایج معمولاً بین 20 تا 40 درصد مربوط به اهداکننده است. تکثیر سلولهای NK جابجا شده از 250 تا 1000 برابر در 20 روز متغیر است که بستگی به رده دهنده و تغذیه کننده دارد. به طور کلی، تکثیر قابل قبول با قابلیت زنده ماندن سلول معمولاً بیشتر از 95٪ نشان داده شده است.
سلولهای NK جابجا شده همچنین پتانسیل سیتوتوکسیک خوبی را در برابر سلولهای K562 و کشتن اهداف CD19 مثبت (سلولهای NALM6) اختصاصی CAR نشان دادند.
مهم است که TcBuster توانایی کشتن طبیعی سلول های NK را مهار نکند، زیرا این امر به ارزش استفاده از آن در سلول درمانی می افزاید.
تجزیه و تحلیل یکپارچه سازی سایت هدف نشان داده است که سیستم ترانسپوزون TcBuster دارای مشخصات درج ایمن تری نسبت به لنتی ویروس است. فاصله متوسط تا محل شروع رونویسی بیشتر از لنتی ویروس است که پتانسیل کمتری را برای تأثیرگذاری بر ژنهای درونزا نشان میدهد. در مقایسه با لنتی ویروس، احتمال کمتری وجود دارد که مکان درج در مناطق اینترون باشد. با لنتی ویروس، درج های اگزون و اینترون بیشتری مشاهده شد، با محل TcBuster نزدیک تر به کنترل نظری تصادفی.
آزمایشهای بیشتری برای ارزیابی پتانسیل کلونالیته انجام شد. از دیدگاه نظارتی سازمان غذا و دارو (FDA)، رشد یک کلون یکپارچه نامطلوب است، زیرا ممکن است نشان دهنده یک سلول T دگرگون شده باشد. فرکانس پایین یک سایت ادغام واحد نشان می دهد که جمعیت سلولی نهایی دارای مجموعه متنوعی از رویدادهای ادغام است که نشان دهنده یک جمعیت متنوع در ابتدا ویرایش شده است. کلون های TcBuster نمایه ادغام متنوعی را نشان دادند که نشان دهنده عدم رشد کلونال است.
TcBuster در حال نزدیک تر شدن به استفاده در محیط بالینی است. Luminary Therapeutics برای یک برنامه دارویی جدید تحقیقاتی (IND) با استفاده از TcBuster در کلینیک برای درمان با سلول های CAR T مبتنی بر لیگاند فاکتور فعال کننده سلول B (BAFF) که سه گیرنده بیان شده در سرطان های سلول B را هدف قرار می دهد، ثبت نام کرده است. TcBuster همچنین روشی کارآمد برای مهندسی و تولید سلولهای CAR NK اولیه با هدف قرار دادن CLL-1 برای لوسمی میلوئید حاد (AML) نشان داده شده است.
علاوه بر این، TcBuster می تواند در برنامه های کاربردی سلول های بنیادی پرتوان القایی (iPSC) مورد استفاده قرار گیرد. این پلتفرم در یک پروژه جایگزینی ژن برای مهندسی iPSCها با یک ژن تحت یک پروموتر سازنده اجرا شد. فاصله متوسط تا محل شروع رونویسی و محل درج در iPSCها و سلول های T اولیه مشابه است. کلون های مورد نظر را می توان از طریق غربالگری ژنتیکی انتخاب کرد.
از دیگر کاربردهای TcBuster میتوان به افزایش تیتر تولید آنتیبادی و در عین حال کاهش همزمان جدول زمانی تولید اشاره کرد. با استفاده از TcBuster داخلی در Bio-Techne، افزایش 32 برابری در تولید CD3 و افزایش 58 برابری در بیان CD28 به دست آمد. TcBuster همچنین برای تولید یک رده سلولی تغذیه کننده پایدار مبتنی بر K562 برای نیازهای کشت سلولی اولیه NK استفاده شده است. همچنین میتواند رده های سلولی پایداری را برای جریانهای صنعتی کشف دارو ایجاد کند، چه بهعنوان جمعیت یا کلونهای با بیان بالا.
Bio-Techne قصد دارد TcBuster را به عنوان پروتئین ارائه کند. علاوه بر این، محققان در تلاش هستند تا به طور مستمر نمایه فعالیت TcBuster را افزایش دهند تا بستهبندیهای بزرگتر را با کارایی بیشتری ارائه دهند. هدف دیگر استفاده از خواص TcBuster به عنوان یک پروتئین همجوشی است. GFP را می توان بدون هیچ افتی در کارایی جابجایی به TcBuster ادغام کرد که پتانسیل بهبود مشخصات یکپارچه سازی و ویژگی آن را ممکن می سازد.
https://insights.bio/cell-and-gene-therapy-insights/journal/article/2585/Accelerating-cell-therapy-discovery-development-with-non-viral-gene-engineering



ارسال به دوستان