سنجش های مبتنی بر CRISPR برای مناطق دارای منابع محدود
سنجش های مبتنی بر CRISPR می توانند به عنوان تشخیص مولکولی فوق حساس در مناطق دارای منابع محدود مورد استفاده قرار گیرند. در اینجا، ما موانع اصلی توسعه این سنجش ها را مورد بحث قرار می دهیم و بینش هایی در مورد چگونگی غلبه بر آنها ارائه می دهیم.
سنجش های مبتنی بر CRISPR می توانند به عنوان تشخیص مولکولی فوق حساس در مناطق دارای منابع محدود مورد استفاده قرار گیرند. در اینجا، ما موانع اصلی توسعه این سنجش ها را مورد بحث قرار می دهیم و بینش هایی در مورد چگونگی غلبه بر آنها ارائه می دهیم.
تشخیص سریع و دقیق برای درمان موثر، ارزیابی پیش آگهی و مهار بسیاری از بیماری ها ضروری است. با این حال، تقریبا نیمی از جمعیت جهان دسترسی محدودی به تشخیص های مولکولی دارند. سنجشهای مبتنی بر فعالیت تکرارهای کوتاه پالیندرومیک خوشهای با فاصله منظم (CRISPR) میتواند به دلیل هزینه کم، تطبیق پذیری و سهولت استفاده، به مشکل طولانی مدت تشخیص در جوامع فقیر، روستایی و حاشیهنشین در سطح جهان بپردازد.
کمپلکسهای CRISPR–Cas و RNA راهنما (gRNA) میتوانند توالیهای اسید نوکلئیک اگزوژن را شناسایی کرده و بشکنند تا تکثیر ویروس را تضعیف کنند. ویژگی این کمپلکسها را میتوان به آسانی با جایگزینی gRNA تنظیم کرد، که منجر به پذیرش سریع آنها در برنامههای ویرایش ژن و بعداً در تشخیص اسید نوکلئیک فوق حساس با ویژگی بالا شده است. اکثر روشهای تشخیص اسید نوکلئیک CRISPR با وجود قوی بودن و توانایی تشخیص اهداف کمیاب در نمونههای بیولوژیکی پیچیده، معیارهای «ASSURED» سازمان جهانی بهداشت را برآورده نمیکنند (POC) که در آن ذکر شده روش می بایست قابل تحویل و قابل استفاده در مناطق دورافتاده یا با منابع محدود باشد.
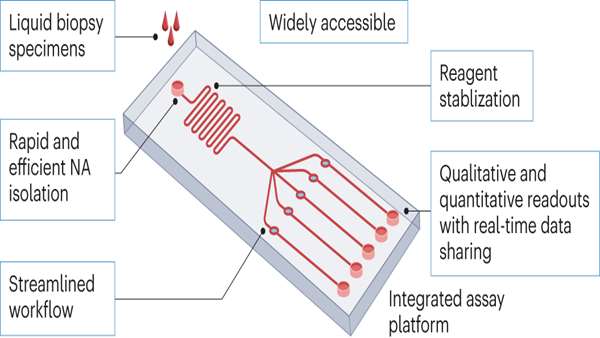
اکثر سنجش های CRISPR شامل استخراج اسید نوکلئیک و مراحل تکثیر هدف است که به آموزش و مواد و تجهیزات گران قیمت نیاز دارد. اصلاحات می توانند گردش کار سنجش و ابزار دقیق را ساده کنند، اما باید در مقابل عملکرد سنجش متعادل شوند. برای مثال، پروتکلهای جداسازی اسید نوکلئیک بدون استخراج که از معرفها و/یا گرما برای آزادسازی اسید نوکلئیک از سلولها، ویروس ها یا کمپلکس های اسید نوکلئیک از نمونه های بالینی استفاده می کنند، ترجیح داده میشوند زیرا واکنش های CRISPR فاکتورهای موجود در نمونه های زیستی را تحمل میکنند. روش های ساده ماتریس میل ترکیبی همچنین می تواند برای متمرکز کردن اهداف اسید نوکلئیک کمیاب و خالص سازی آنها از عوامل بازدارنده برای دستیابی به نهایت حساسیت استفاده شود. به طور مشابه، روش هایی که واکنش های CRISPR را در حجم های کوچک محدود می کنند، می توانند تولید سیگنال را تشدید کنند. این استراتژی می تواند به ویژه برای تجزیه و تحلیل درجا اهداف اسید نوکلئیک در وزیکول های خارج سلولی گرفته شده از نمونه برداری های مایع، که میتوانند با لیپوزوم های دارای معرف ترکیب شوند، مفید باشد.
مراحل تکثیر اسید نوکلئیک مجزا زمان و پیچیدگی سنجش را افزایش می دهد و خطر آلودگی متقابل را در طول انتقال نمونه به واکنش CRISPR ایجاد می کند. در روش دیگر، تکثیر اسید نوکلئیک و واکنش های CRISPR میتوانند به ترتیب با استفاده از دستگاه های میکروسیال یا واکنش های تک چاهکی با پارامترهای واکنش بهینه، بهطور متوالی یا همزمان بدون انتقال سیال انجام شوند. حذف مرحله تکثیر اسید نوکلئیک هدف می تواند زمان سنجش، هزینه و خطر آلودگی را کاهش دهد، اما به یک سیستم بازخوانی سیگنال فوق حساس برای اطمینان از عملکرد قابل قبول سنجش موردنظر نیاز دارد. برای مثال، سنجشهای چندگانه که از کمپلکسهای متمایز CRISPR-Cas و gRNA برای شناسایی مکانهای مختلف در یک هدف اسید نوکلئیک استفاده می کنند، میتوانند عملکرد سنجش های CRISPR بدون تکثیر هدف را بهبود بخشند، اما در عین حال هزینههای سنجش را افزایش داده و اختصاصیت را متناسب با تعداد اهداف اضافه شده کاهش می دهد.
بنابراین، به جای ساده سازی گام های جداگانه، اصلاحات برای برنامه های POC باید بر روی ادغام سیستماتیک روش های سنجش CRISPR در دستگاه های کاربرپسند، مانند تراشههای میکروسیال یا سنجشهای جریان جانبی تمرکز کنند. این رویکرد همچنین میتواند برای توسعه دستگاههای پوشیدنی استفاده شود که میتوانند به عنوان تستهای چندگانه برای تشخیص بیماری یا قرار گرفتن در معرض عوامل خاص محیطی عمل کنند.
بازخوانی های سنجش حساس و کمی CRISPR در حال حاضر عمدتاً به تغییرات سیگنال فلورسنت یا الکتریکی که توسط تجهیزات آزمایشگاهی پیچیده شناسایی میشوند متکی هستند که در مناطق با منابع محدود یا از راه دور قابل استفاده نیستند. با این حال، حسگرهای رنگ سنجی مبتنی بر نانومواد می توانند به راحتی در سنجش های CRISPR ادغام شوند تا جایگزین خروجی های سیگنال فلورسانس شوند. تغییرات رنگی که منعکس کننده فراوانی اسید نوکلئیک هدف در این سنجش ها است را می توان با چشم غیر مسلح خواند اما داده های کمی ارائه نمی دهد. با این حال، نمودارهای کنترل رقیقسازی استاندارد یا معادلهای آنها را میتوان در این سنجشها گنجاند تا نتایج نیمه کمی یا کمی را در صورت خواندن با چشم غیرمسلح یا دستگاههای معمولی، قابل حمل و ارزان قیمت، از جمله گوشیهای هوشمند، ارائه دهند. قابل ذکر است، اتصال شبکه ای این دستگاه ها به اشتراک گذاری داده های رمزگذاری شده در زمان واقعی با آژانس های ملی یا بیمارستان های مرکزی امکان می دهد تا تحقیقات اپیدمیولوژیک، تصمیم گیری های کنترل بیماری را تسهیل کند و برنامه های پزشکی از راه دور را فعال کند که می تواند مراقبت از بیمار را در مناطق دورافتاده، با منابع محدود یا مناطق محروم بهبود بخشد.
گزارشهای سنجشهای جدید CRISPR اغلب فاقد دادههای دقیق دارای اعتبار بالینی لازم برای ارزیابی دقیق عملکرد تشخیصی و کاربرد بالینی آنها هستند. اکثر این مطالعات از گروههای نمونه گذشتهنگر کوچک برای گزارش حساسیت و ویژگی تشخیصی استفاده میکنند که میتواند داده را معرفی کند، بهویژه اگر نمونههای تجزیهوتحلیلشده به شیوهای مناسب جمعآوری یا مدیریت نشده باشند. مطالعاتی که برای تایید عملکرد تشخیصی روش CRISPR انجام میشود، نیازمند استانداردهای مرجع مناسب هستند، زیرا سنجشهای CRISPR با حساسیت بالا میتوانند از عملکرد تشخیصی سنجشهای بالینی مرجع فراتر رفته و بنابراین نیاز به مقایسه با استانداردهای مرجع مرکب دارند که نتایج حاصل از چندین آزمایش یا یافته بالینی را ادغام میکنند. توسعه و اتخاذ رویکردهای معتبر استاندارد برای تجزیه و تحلیل دادههای CRISPR نیز به فوریت مورد نیاز است تا امکان گزارش دهی یکنواخت و مقایسه نتایج حاصل از سنجشهای مختلف CRISPR فراهم شود.
هنگام در نظر گرفتن مناطق دارای منابع محدود باید جنبه های حمل و نقل و ذخیره سازی نیز در نظر گرفته شود. معرف های لیوفیلیزه CRISPR را می توان در دمای 4 درجه سانتیگراد به مدت بیش از 5 ماه و در دمای اتاق تا 30 روز بدون کاهش عملکرد قابل توجه نگهداری کرد. با این حال، اطلاعات کمتری در مورد پایداری معرف در شرایط دمایی محیطی متغیرتر شناخته شده است، و توسعه و پذیرش پروتکلهای تثبیت معرف استاندارد باید از توسعه سنجشهای POC CRISPR سود زیادی ببرد. در ابتدای توسعه، آزمایشهای POC جدید باید به عنوان حداقل نیاز، عملکرد سنجش را پس از لیوفیلیزاسیون معرف و هیدراتاسیون مجدد ارزیابی و بهینه کنند تا در غیاب مدیریت قوی زنجیره سرد، عمر مفید خود را افزایش دهند.
در نهایت، فرآیندهای سادهسازی مجوز ثبت اختراع و مجوز بازار برای معرفهای CRISPR و سنجشهای CRISPR برای استانداردسازی و افزایش تولید، کاهش هزینههای توسعه سنجش و تولید و موانع ورود به بازار، و تنوع و تثبیت زنجیرههای تامین نیاز است. با توجه به پتانسیل تشخیص CRISPR، ساده کردن این فرآیندها توصیه می شود، همانطور که برای تشخیص SARS-CoV-2 PCR در اوایل همه گیری COVID-19 انجام شد، زمانی که مقامات دولتی در چندین کشور از سیاست های مجوز استفاده اضطراری برای گسترش ظرفیت آزمایش استفاده کردند.
https://www.nature.com/articles/s44222-023-00026-8



ارسال به دوستان