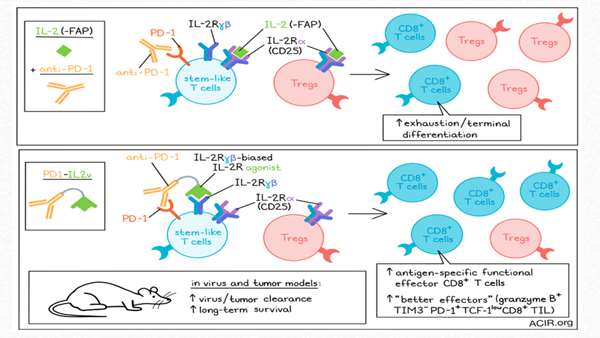
محققان ایمونوسایتوکاینی به نام PD1-IL2v را مهندسی کردند که موجب توسعه قوی تر و اختصاصی تر سلول های effector مناسب میشود
اینترلوکین-2 (IL-2) می تواند تمایز سلول های T شبه بنیادی را به جمعیت سلول های CD8+ T با عملکردهای موثرتر در عفونت مزمن القا کند. با این حال، درمان سیستمیک از طریق IL-2 موجب ایجاد آثار نامطلوب، از جمله افزایش سلول های T تنظیمی(Tregs)می شود.
اینترلوکین-2 (IL-2) می تواند تمایز سلول های T شبه بنیادی را به جمعیت سلول های CD8+ T با عملکردهای موثرتر در عفونت مزمن القا کند. با این حال، درمان سیستمیک از طریق IL-2 موجب ایجاد آثار نامطلوب، از جمله افزایش سلول های T تنظیمی(Tregs)می شود. به منظور غلبه بر این مشکل، محققان یک ایمونوسایتوکاین به نام PD1-IL2v را مهندسی کردند که موجب توسعه قویتر و اختصاصیتر سلولهای effector مناسب میشود. این درمان در مدلهای عفونت مزمن و سرطان مورد آزمایش قرار گرفته و نتایج آن اخیراً در ژورنال Nature منتشر شده است.
محققان PD1-IL2v را به منظور ارائه آگونیسم IL-2R ترجیحاً به سلولهای T + PD-1 واکنشدهنده با تومور یا ویروس طراحی کردند و یک آنتیبادی متصلشونده به PD-1 را به یک آگونیست وابسته به زنجیره γ و β گیرنده IL-2 متصل نمودند، بنابراین مسیر PD-1 مسدود میگردد. برای ارزیابی آنکه آیا PD1-IL2v میتواند بر سلول های T تنظیمی(Tregs)آثار تحریکی داشته باشد، رقابت اتصال و سنجش های سرکوب با Tregs و conventional CD4+ T cells (Tconv) انجام شد. PD1-IL2v ترجیحاً به Tconv که دارای سطوح بالاتری از PD-1 نسبت به Tregs بود، متصل میشد. اتصال PD1-IL2v به Tconv به این سلول ها کمک کرد تا بر سرکوب بواسطه سلولهای T تنظیمی(Tregs) به روش وابسته به دوز غلبه کنند.
لنفوسیتهای T که گیرنده αβ سلول های Tو همچنین گیرنده CD4 یا CD8 را بیان میکنند و در خون محیطی، غدد لنفاوی و بافت ها (مانند پوست) وجود دارند، سلول های T conventional (Tconv) در نظر گرفته میشوند.
محققان دریافتند PD1-IL2v همچنین میتواند ترشح GM-CSF و گرانزیم B را در سلولهایT PD-1+ CD4 + به صورت وابسته به دوز القا کند.
GM-CSF (Granulocyte-macrophage colony-stimulating factor) یک فاکتور رشد است که تعداد گلبولهای سفید در گردش و عملکرد نوتروفیل ها و مونوسیت ها را افزایش میدهد.
گرانزیم B، سرین پروتئازی ست که مجموعهای از سیگنالها را درون سلول هدف آغاز میکند و موجب القای مرگ برنامهریزیشده در سلول هدف میشود. گرانزیم B، سبب ازهمگسیختگی ساختارهایی مانند غشای میتوکندری و تغییر نفوذپذیری آن میشود. از سوی دیگر با تحریک ترشح انواع دیگری از پروتئازها، تخریب DNA را القا میکند. عملکرد پروآپوپتوز گرانزیم B زمینه ساز توانایی سلولهای ایمنی سایتوتوکسیک هم چون لنفوسیت های T سایتوتوکسیک (CTLs) و سلولهای کشنده طبیعی (NK) برای از بین بردن سلول های هدف آلوده به ویروس و توموری میباشد.
همراهی anti-PD-L1 و PD1-IL2v نسبت به تک درمانی anti-PD-L1 در افزایش تعداد سلول های CD8+ T اختصاصی ویروس کوریومننژیت لنفوسیتیک (LCMV) در بافت های مختلف برتر بود. این سلولهای T اختصاصی، IFNγ، TNFα و/یا IL-2 را تولید میکردند و دارای تغییرات ناشی از درمان در بیان نشانگرهای فنوتیپی بودند. افزایش بیان Cd28، گیرنده های مختلف سایتوکاین، کموکاین های مربوط به مهاجرت سلولهای T، مولکول های چسبنده و مولکول های مربوط به خروج از بافت های لنفاوی از ویژگیهای سلولهای CD8+ T effector عملکردی هستند، در حالی که نشانگرهای سلول T خسته و فاکتورهای رونویسی مانند Tox و Pdcd1 کاهش یافتند. تک درمانی PD1-IL2v همچنین موجب افزایش سلول های CD8 + T اختصاصی LCMV شد، اما درمان ترکیبی تعداد را بیشتر افزایش داد و منجر به تغییرات فنوتیپی مشخصتری شد.
به منظور ارزیابی اثرات ضد توموری، موشهای حامل تومورهای زیر جلدی Panc02-H7Fluc با PD1-IL2v، IL-2 با دوز بالا، یا هر یک از درمانهای مونوتراپی همراه با anti-PD-L1 تحت درمان قرار گرفتند. کاهش بقا و رشد تومور در موشهای تحت درمان با مونو تراپی PD1-IL2v نسبت به موشهایی که با ترکیب دوز بالا IL-2 و anti-PD-L1 درمان شده بودند، مشخصتر بود. همراهی PD1-IL2v و anti-PD-L1 اثربخشی را مختل نکرد، اما مزیت بیشتری را نیز به همراه نداشت.
منبع:



ارسال به دوستان