مکانیسم جدید ترمیم DNA ، نوید درمان دقیق سرطان را می دهد
دانشمندان دانشگاه بیرمنگام و موسسه فرانسیس کریک روش جدیدی را کشف کرده اند که در آن سلول های سرطانی شکستگی های دو رشته ای در DNA را ترمیم می کنند.
دانشمندان دانشگاه بیرمنگام و موسسه فرانسیس کریک روش جدیدی را کشف کرده اند که در آن سلول های سرطانی شکستگی های دو رشته ای در DNA را ترمیم می کنند.
یافته ها در مقاله ای با عنوان «متیلاسیون H3K4 توسط SETD1A/BOD1L NHEJ وابسته به RIF1 را تسهیل میکند» در مجله Molecular Cell در 19 مه 2022 منتشر شد. این کار چگونگی واکنش سلول های سرطانی به شیمیدرمانی و پرتودرمانی را نشان میدهد. سلول های سرطانی ممکن است در برابر درمان مقاومت کنند. این بینش می تواند به توسعه رویکردهای پزشکی دقیق برای بیماران سرطانی کمک کند.
این مطالعه از همکاری آزمایشگاه هایی به رهبری مارتین هیگز، دکترا، دانشیار ژنومیک و بیماری های نادر و معاون مدیر مرکز مطالعات بیماری های نادر در دانشگاه بیرمنگام، گرانت استوارت، دکترا، پروفسور ژنتیک سرطان در دانشگاه بیرمنگام، موسسه سرطان و علوم ژنومی در دانشگاه بیرمنگام، و سیمون بولتون، دکترا، رهبر گروه ارشد در موسسه فرانسیس کریک و استاد افتخاری دانشگاه کالج لندن حاصل شده است.
شکستگی دو رشته ای (DSB) در DNA نشانه وقوع مشکل است که می تواند به طور خود به خود با قرار گرفتن در معرض اکسیداسیون یا تشعشعات یونیزه کننده بیش از حد، یا زمانی که یک ناحیه باز نشده از DNA که در حال رمزگشایی فعال است (که چنگال همانندسازی نامیده می شود) فرو بریزد. آنها همچنین می توانند به عنوان بخشی از یک سیستم برنامه ریزی شده برش و اتصال بخش های DNA در طول تکامل سیستم ایمنی (نوترکیبی سوئیچ کلاس) ایجاد شوند.
ترمیم DSB برای ادامه سلامت سلولی حیاتی و برای پیشگیری از سرطان ضروری است. درک چگونگی ترمیم DSBها در درک علل سرطان، پیشبینی اثربخشی درمانهای سرطان، و طراحی درمانهای فردی که از آسیب DNA هدفمند برای از بین بردن سلول های سرطانی استفاده میکنند، بسیار مهم است.
سلول ها دو روش ثابت برای تعمیر DSB دارند. روشی که به طور ذاتاً مستعد خطا برای ترمیم DSB ها است، شامل نزدیک کردن دو انتهای شکسته DNA برای فعال کردن آنزیم های لیگاز به منظور مهر و موم کردن شکست است. این مسیر، که برای تعمیر نیازی به الگو ندارد و در طول چرخه سلولی رخ می دهد، اتصال انتهایی غیر همولوگ (NHEJ) نامیده می شود.
راه دیگر ترمیم DSBها به یک الگو نیاز دارد و بنابراین فقط در مرحله سنتز (S) یا رشد دوم (G2) یک چرخه سلولی زمانی رخ میدهد که یک کروموزوم تکراری (کروماتید خواهر) برای ایفای نقش به عنوان الگو در دسترس باشد. این حالت بسیار دقیق ترمیم به نام نوترکیب همولوگ (HR) به برداشتن انتهای رشته برای ایجاد یک الگوی همولوگ برای تعمیر نیاز دارد.
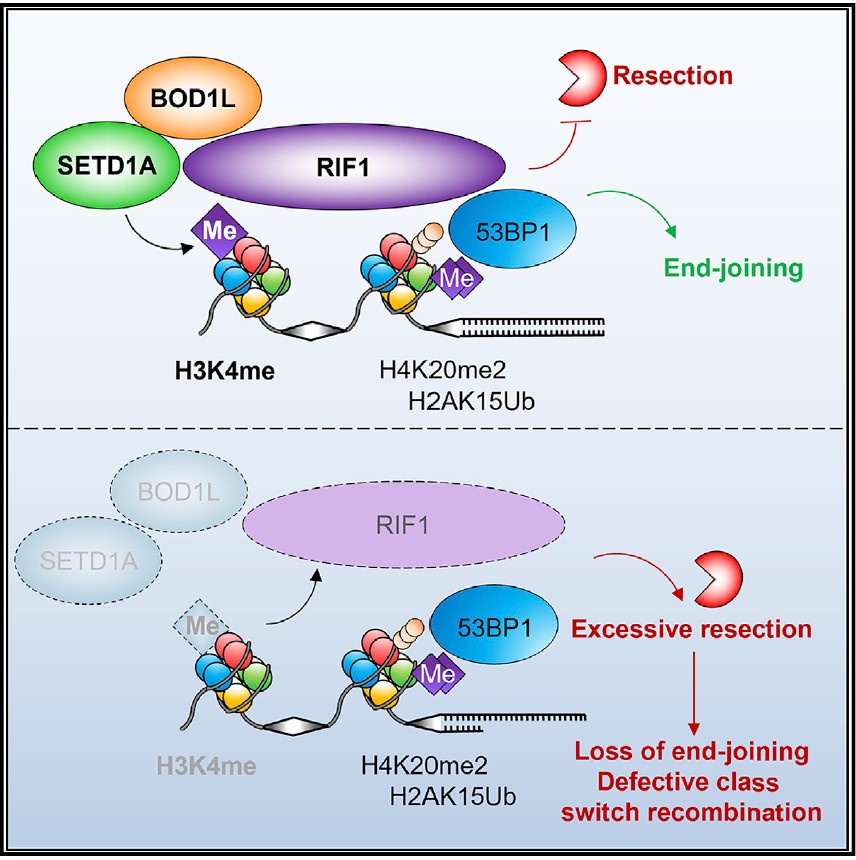
بنابراین، اولین گام در ترمیم DNA DSB تصمیم گیری است که کدام یک از این دو مسیر باید اتخاذ شود. مسیر مولکولی 53BP1-RIF1-shieldin نقش مهمی در این تصمیم ایفا می کند و از تخریب در انتهای شکسته DNA DSB جلوگیری می کند و به نفع NHEJ مسیر را پیش می برد. مطالعات قبلی نشان داده است که پروتئین ترمیم کننده به نام RIF1 با کروماتین آسیب دیده از طریق 53BP1 فسفریله شده برهم کنش می کند تا به DSB کمک کند. اما مشخص نیست که آیا سایر نشانه های نظارتی به این مکانیسم کمک می کند یا خیر.
مطالعه جدید متیلاسیون پروتئین داربست DNA هیستون H3 را در چهارمین اسیدآمینه آن (لیزین) توسط دو پروتئین SETD1A-BOD1L نشان میدهد که RIF1 را به DSB فراخوانی میکند.
هیگز گفت: «هر سه آزمایشگاه علاقه مند به توصیف چگونگی ترمیم DNA و عوامل ژنتیکی و اپی ژنتیکی هستند. چند سال پیش، ما یک فاکتور ترمیم DNA جدید، BOD1L، و نقش آن در طول همانندسازی DNA را توضیح دادیم. در طول این مطالعات اولیه بر روی BOD1L، ما همچنین مشاهده کردیم که در ترمیم شکستگی های دو رشته ای DNA نقش دارد که منجر به این مطالعه شد. از آنجایی که ما همچنین از کارهای قبلی میدانیم که BOD1L با اصلاحکننده اپی ژنتیکی SETD1A تعامل دارد، کار روی هر دو این ژنها را ترکیب کردیم.
مطالعه حاضر به نقش پروتئین های SETD1A و BOD1L در فرآیند ترمیم DNA اشاره می کند. این تیم نشان می دهد که حذف این پروتئین ها، نحوه ترمیم DNA را تغییر می دهد و حساسیت سلول های سرطانی به درمان را دستخوش دگرگونی می کند. به ویژه، نویسندگان نشان میدهند که مانع از بیان SETD1A یا BOD1L یا ممانعت از متیلاسیون H3K4 میشود که به برداشتن نامحدود انتهای DNA DSB اجازه میدهد و NHEJ و نوترکیبی سوئیچ کلاس را مختل میکند.
سه یافته اصلی از این مقاله وجود دارد. اول، ما دو پروتئین جدید (BOD1L و SETD1A) را شناسایی کردهایم که برای ترمیم شکستگی های دو رشتهای DNA حیاتی هستند. ثانیاً، ما کشف کردهایم که تغییرات اپی ژنتیکی کاتالیز شده توسط SETD1A با کنترل پروتئین ترمیم RIF1، ترمیم شکست دو رشتهای را در سطح کاملاً جدیدی تنظیم میکند. در نهایت، فقدان SETD1A به درمان های ضد سرطانی هدفمند در سلول هایی که دارای نقص ژن سرکوبگر تومور BRCA1 هستند، مقاومت ایجاد میکند.
هیگز افزود: «این اولین بار است که این ژنها مستقیماً با ترمیم DNA در سرطان مرتبط میشوند. این تحقیق این پتانسیل را دارد که نحوه شناسایی بیماران سرطانی برای درمان و مقاومت آنها در برابر داروهای مختلف را تغییر دهد که باعث بهبود کارایی درمان و همچنین نتایج بیمار می شود.
این تیم امیدوار است که این کار منجر به توسعه مهارکننده های جدیدی شود که سلول های سرطانی مقاوم به درمان را دوباره حساس میکنند. این تیم در حال حاضر در حال پیگیری آزمایش هایی برای درک اینکه چگونه SETD1A و BOD1L یکدیگر را تنظیم میکنند و RIF1 را کنترل میکنند، و اینکه آیا یافتههای مطالعه کنونی ارتباط بالینی در بیماران سرطانی دارد یا خیر.
https://www.genengnews.com/topics/cancer/new-dna-repair-mechanism-holds-promise-for-precision-cancer-therapies/



ارسال به دوستان