ابزارهای ویرایش ژنوم میتوکندری انسان گسترش می یابند
دانشمندان مرکز مهندسی ژنوم در مؤسسه علوم پایه (IBS) در کره جنوبی، ابزاری قابل برنامه ریزی ایجاد کرده اند که می تواند تبدیل باز آدنین (A) به گوانین (G) را در ژنوم میتوکندری انسان انجام دهد.
دانشمندان مرکز مهندسی ژنوم در مؤسسه علوم پایه (IBS) در کره جنوبی، ابزاری قابل برنامه ریزی ایجاد کرده اند که می تواند تبدیل باز آدنین (A) به گوانین (G) را در ژنوم میتوکندری انسان انجام دهد.
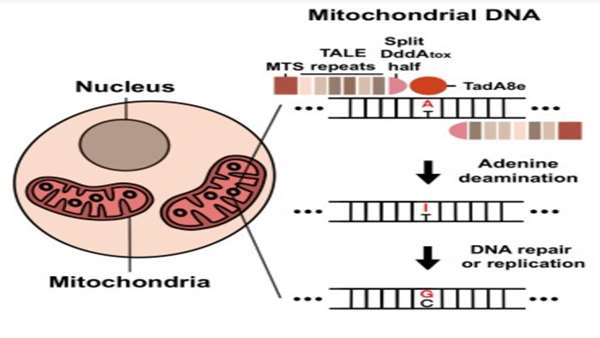
ویرایشگرهای ژن مورد استفاده در پلتفرم جدید ویرایش ژن میتوکندری TALEDs (دامینازهای مرتبط با عامل شبه فعال کننده رونویسی) نامیده می شوند و دارای سه جزء هستند: یک TALE با طراحی سفارشی (عامل فعال کننده رونویسی) که یک توالی DNA را هدف قرار می دهد. دئوکسی آدنوزین دآمیناز مهندسی شده (TadA8e) مشتق شده از پروتئین Escherichia coli TadA که A را به G تبدیل می کند، و یک سیتیدین دآمیناز (DddA) که DNA را باز و آن را برای TadA8e قابل دسترس تر می کند.
Sung-Ik Cho، دکترا، نویسنده اول مطالعه جدید، گفت: "ما یک پلتفرم ویرایش ژن جدید به نام TALED ایجاد کردیم که می تواند تبدیل A به G را انجام دهد. ویرایشگر ژن جدید ما به طور چشمگیری دامنه ویرایش ژنوم میتوکندری را گسترش می دهد. این امر می تواند نه تنها در ساخت یک مدل بیماری، بلکه در توسعه یک درمان نیز سهم بزرگی داشته باشد.
جزئیات پلتفرم جدید ویرایش mtDNA در مجله Cell منتشر شد.
این یک مطالعه جالب است که ابزارهای ویرایش ژنوم را با دآمینازهای مرتبط با TALE برای جهش های دقیق A-to-G گسترش می دهد. این مفهوم در DNA میتوکندری انسان با کارایی بالا که امکان پیدایش مدل های بیماری را فراهم می کند، دلگرم کننده است. در حالی که نیاز به بهینه سازی اختصاصیت در کاربردهای بالینی وجود دارد، این رخداد در واقع گسترش جعبه ابزار ویرایش ژنوم برای مجموعهای از کاربردهای متفاوت در DNA میتوکندری، با پتانسیل بالقوه در سلولهای پستانداران و فراتر از آن است.
توانایی تغییر کد ژنومی با اکتشاف آنزیم های محدود کننده در سال 1968، واکنش زنجیره ای پلیمراز در سال 1985، نوکلئازهای انگشت روی در سال 1996، برهمکنش های DNA-افکتور TAL در سال 2009، ویرایش ژن CRISPR-Cas9 و ویرایش جفت باز در سال 2012 به تدریج افزایش یافته است. در سال 2016. این اکتشافات امکان درمان بیماری های ژنتیکی که قبلاً صعب العلاج بودند را با ویرایش جهش های بیماری زا در ژنوم انسان ممکن ساخته است. با این حال، ابزارهای ویرایش ژنوم سلول زنده تا حد زیادی بر روی ژنوم هسته ای متمرکز شده اند.
جهش در DNA حلقوی میتوکندری (mtDNA) که از مادر به ارث می رسد، مسئول چندین بیماری شدید است. 90 جهش نقطه ای بیماری زا در mtDNA وجود دارد که از هر 5000 نفر حداقل 1 نفر را تحت تاثیر قرار می دهد.
برخی از بیماری های ارثی شدید به دلیل نقص در mtDNA ایجاد می شوند. به عنوان مثال، نوروپاتی بینایی ارثی لبر (LHON)، که باعث کوری ناگهانی در هر دو چشم می شود، توسط یک جهش ساده تک نقطه ای در mtDNA ایجاد می شود.
علاوه بر این، MELAS (آنسفالومیوپاتی میتوکندری با اسیدوز لاکتیک و دورههای مشابه سکته مغزی) به تدریج به مغز بیمار حمله میکند. مطالعات دیگر نشان می دهد که ناهنجاری های mtDNA ممکن است مسئول بیماری های دژنراتیو مانند بیماری آلزایمر و دیستروفی عضلانی نیز باشد.
ابزارهای ویرایش ژنوم موجود را نمی توان برای ویرایش mtDNA به دلیل محدودیت در روش های انتقال به سلول استفاده کرد. به عنوان مثال، RNA های راهنمای استفاده شده در پلتفرم CRISPR-Cas قادر به ورود به میتوکندری نیستند.
مشکل دیگر این است که کمبود مدل های حیوانی برای این بیماری های میتوکندریایی وجود دارد. این مسئله به این دلیل است که در حال حاضر امکان مهندسی جهشهای میتوکندریایی لازم برای ایجاد مدلهای حیوانی وجود ندارد.» از سوی دیگر فقدان مدل های حیوانی، توسعه و آزمایش روش های درمانی برای این بیماری ها را بسیار دشوارتر می کند.
با کشف ویرایشگرهای جفت باز سیتوزینی مشتق از DddA (DdCBEs) در سال 2020 توسط تیمی به سرپرستی دیوید لیو، استاد انستیتوی برود هاروارد و MIT، و جوزف موگوس، استاد دانشگاه واشنگتن، مشخص شد که امکان انجام تبدیل سیتوزین (C) به تیمین (T) در mtDNA بدون ایجاد شکست های DNA دو رشته ای وجود دارد. با این حال، DdCBEs تا حد زیادی به تبدیل C-به-T در موتیف TC محدود شده و می توانست تنها حدود 10٪ جهش های نقطه میتوکندری بیماری زا را اصلاح کند.
لیو، که در مطالعه فعلی شرکت نداشته است، به پایگاه خبری گفت: «جین سو و گروهش به زیبایی نشان دادند که چگونه ادغام ویرایشگر جفت باز سیتوزین میتوکندری و آنزیم دآمینازی که برای ویرایشگرهای جفت باز آدنین هستهای خود تکامل دادهایم، میتواند به هدف مهم ویرایش جفت باز آدنین در DNA میتوکندری منجر شود. اگرچه جهش در DNA میتوکندری باعث بسیاری از بیماریهای ژنتیکی جدی میشود، میتوکندریها قبلاً به دلیل دشواری تحویل RNAهای راهنمای CRISPR به داخل میتوکندری در برابر ویرایش دقیق ژن مقاومت داشتند.
نویسندگان گزارش کردند که TALED های طراحی شده سفارشی، A را به طور موثر در سلول های انسانی در 17 هدف در ژن های مختلف میتوکندری با فرکانس ویرایش 49 درصدی تبدیل کرده اند.
علاوه بر این، TALED هیچ سمیت سلولی نشان نداد و یکپارچگی mtDNA را حفظ کرد. TALED ها هیچ ویرایش نامطلوب خارج از هدف در DNA هسته ای ایجاد نکردند و تنها اثرات خارج از هدف بسیار کمی در mtDNA. داشتند.
در مطالعات آتی، محققان قصد دارند با افزایش کارایی و اختصاصیت ویرایش TALED ها را بهبود بخشند تا راه را برای کاربرد این فناوری در بیماران هموار کنند. این تیم همچنین در حال توسعه TALED های مناسب برای ویرایش پایه A-to-G در DNA کلروپلاست هستند.
https://www.genengnews.com/topics/genome-editing/human-mitochondrial-genome-editing-toolkit-expands/



ارسال به دوستان